AAV 벡터 시스템, AAV 생산, 형질도입 및 AAV 유전자 치료
아데노부속바이러스 (AAV 벡터) -소개
아데노부속바이러스 (AAV) 벡터 시스템, AAV 생산, AAV 형질도입 및 AAV 유전자 치료의 랜드스케이프, 프로토콜 및 가이드라인을 아래에 설명합니다. AAV 벡터 플라스미드 클로닝, AAV 패키징, 정제, AAV 캡시드 진화 및 AAV 유전자 치료의 통찰력에 대한 자세한 정보를 제공합니다.
아데노부속바이러스 (AAV 벡터) -목차
- 1. 아데노부속바이러스 (AAV) 벡터란?
- 2. AAV 유전자 치료 리뷰
- 3. AAV 벡터 매개 유전자 전달의 장단점
- 4. AAV 유전체 구조 (ITR, Rep, Cap, VP1, VP2, VP3) 및 AAV 바이러스 조립
- 5. AAV 바이러스의 생애 주기 - 감염에서 재생까지
- 6. AAV 혈청형 및 AAV 조직 특이적 트로피즘
- 7. AAV 벡터 시스템 (AAV 벡터 시스템)
- 8. AAV 엔지니어링 (AAV 캡시드 진화)
- 9. AAV 벡터 형질도입 - AAV 벡터 유전자 전달 in vivo
- 10. 아데노부속바이러스 (AAV 벡터) - 생산 프로토콜, 가이드라인 및 참고문헌
아데노부속바이러스 (AAV 벡터) 및 AAV 유전자 치료 - 지식 베이스
1. 아데노부속바이러스 (AAV) 벡터란?
아데노부속바이러스 (AAV)는 1960년대 피츠버그의 밥 애치슨과 NIH의 월리스 로우가 아데노바이러스 준비 과정에서 오염물로 처음 기술한 인간 파보바이러스의 작은 단일 가닥 DNA 바이러스입니다 [1,2]. 발견 직후, AAV는 인간에서 분리되었지만, 혈청학적 연구에 따르면 AAV 자체는 아데노바이러스나 헤르페스바이러스와 같은 보조 바이러스에 감염된 사람들에게 존재하더라도 질병을 일으키지 않는 것으로 나타났습니다 [3]. 재조합 AAV 벡터 (rAAV)의 개발로 AAV 복제에 필요한 아데노바이러스 보조 유전자가 확인되어 AAV 생산을 위한 플라스미드에 클로닝되어 보조 바이러스의 필요성을 해소했습니다. 현재, AAV 생산은 AAV-293 세포에서의 3 플라스미드 공동 형질도입 시스템 (관심 유전자가 있는 AAV 플라스미드, AAV 패키징 플라스미드 AAV-RC (AAV 복제 및 AAV 캡시드) 및 pHelper (AAV 보조 플라스미드))을 채택하여 AAV 정제 과정을 크게 단순화하고 있습니다.
2. AAV 유전자 치료 리뷰
AAV는 가장 우수한 유전자 치료 벡터로 증명되었습니다. 현재까지 AAV 벡터를 사용한 유전자 전달을 위해 204건 이상의 임상 시험이 수행되었으며 [4], 많은 질병에 대해 유망한 유전자 치료 결과가 Phase 1, Phase 2, Phase 3 시험에서 얻어졌습니다 (표 1), 리포단백질 리파아제 결핍증 (LPLD) [5], 척수성 근위축증 (SMA) [6], 망막 이영양증 [7,8], 낭포성 섬유증 [9,10], 뒤시엔 근이영양증 [11], 혈우병 [12], 울혈성 심부전 [13], 파킨슨병 [14], 및 류마티스 관절염 [15,16] 등. 그 중에서도 스파크사의 Luxturna는 망막 이영양증 환자 치료를 위해 FDA에서 승인되었고, AveXis사의 AVXS-101은 척수성 근위축증 환자에게 우수한 치료 효과를 나타냈으며, 마이크로디스트로핀 및 응고인자 IX를 사용한 AAV는 뒤시엔 근이영양증 및 혈우병 치료에 큰 가능성을 보였습니다.
a)망막 이영양증 치료를 위한 Luxturna
FDA는 2017년 12월 LCA (레버 선천성 흑내장) 환자의 망막 이영양증 치료를 위해 설계된 1회성 유전자 치료 제품인 LUXTURNA™ (voretigene neparvovec-rzyl)를 승인했습니다. LUXTURNA는 미국에서 유전성 망막 질환 (IRD)에 대한 최초의 약리학적 치료법으로 승인된 것이며, 유전성 질환에 대한 최초의 AAV 벡터 유전자 치료입니다. LUXTURNA는 AAV2를 사용하여 RPE65 유전자의 기능적 사본을 망막 색소 상피 (RPE) 세포에 전달하여 RPE65 변이를 보완합니다 [17]. 기능적 RPE65 유전자가 도입됨에 따라, 망막 색소 상피 세포는 RPE65 단백질을 생성하기 시작하고 [18], 시각 사이클을 회복하기 위해 중요한 시각 색소 성분인 11-cis-레티날이 재생됩니다 [4,19]. 현재까지, Phase 1 시험은 RPE65 매개 유전성 망막 이영양증에서 유전자 대체의 잠재적 이익을 보여주었으며, Phase 3 시험에서도 유전성 망막 이영양증 참가자에게 Luxturna 유전자 치료의 유효성과 안전성이 입증되었습니다 [20].
| Indication | Gene | AAV serotype | Route of AAV delivery | Phase | Sponsor |
| Lipoprotein lipase deficiency | LPL | AAV1 | Intramuscular | II–Ⅲ | Amsterdam Molecular Therapeutics |
| LPL | AAV1 | Intramuscular | Ⅰ | UniQure Biopharma B.V. | |
| Spinal muscular atrophy 1 | SMN | AAV9 | Intravenous | Ⅰ | AveXis |
| SMN | AAV9 | Intravenous | Ⅲ | AveXis | |
| SMN | AAV9 | Intravenous | Ⅲ | AveXis | |
| Spinal muscular atrophy | SMN | AAV9 | Intravenous | Ⅰ | AveXis |
| SMN | AAV9 | Intravenous | Ⅲ | AveXis | |
| SMN | AAV9 | Intravenous | Ⅲ | AveXis | |
| Retinal dystrophy | RPE65 | AAV2 | Subretinal | Ⅰ–Ⅱ | University College, London |
| PDE6B | AAV5 | Subretinal | Ⅰ–Ⅱ | Horama S.A | |
| Cystic fibrosis | CFTR | AAV5 | Lung, via aerosol | Ⅰ | NIDDK |
| Hemophilia A | HLP-FVIII-V3 | AAV8 | Intravenous | Ⅰ | University College, London |
| Hemophilia B | FIX | AAV2 | Intravenous | Ⅰ | Spark Therapeutics |
| FIX16 | AAVrh10 | Intravenous | Ⅰ–Ⅱ | Ultragenyx Pharmaceutical Inc | |
| Arthritis | TNFR:Fc | AAV2 | Intraarticular | Ⅰ | Targeted Genetics Corporation |
| TNFR:Fc | AAV2 | Intraarticular | Ⅰ–Ⅱ | Targeted Genetics Corporation | |
| hIFN-b | AAV5 | Intraarticular | Ⅰ | Arthrogen | |
| hIFN-b | AAV5 | Intraarticular | Ⅰ | Arthrogen | |
| Congestive heart failure | SERCA2a | AAV1 | Intracoronary | Ⅰ–Ⅱ | Celladon Corporation |
| SERCA2a | AAV1 | Intracoronary | Ⅱ | Celladon Corporation | |
| SERCA2a | AAV1 | Intracoronary | Ⅱ | Imperial College London | |
| SERCA2a | AAV1 | Intracoronary | Ⅱ | Assistance Publique - Hôpitaux de Paris | |
| SERCA2a | AAV1 | Intracoronary | Ⅰ–Ⅱ | Celladon Corporation | |
| Parkinson's disease | GAD | AAV2 | Surgical infusion | Ⅰ | Neurologix, Inc. |
| GAD | AAV2 | Intrastriatal | Ⅰ | Genzyme, a Sanofi Company | |
| NTN | AAV2 | Intrastriatal | Ⅰ | Genzyme | |
| NTN | AAV2 | Bilateral Intraputaminal (IPu) | Ⅱ | Genzyme | |
| NTN | AAV2 | Bilateral Intraputaminal and Intranigral | Ⅰ–Ⅱ | Sangamo Therapeutics | |
| Alzheimer's disease | NGF | AAV5 | Bilateral, stereotactic | Ⅰ | Ceregene |
| APOE2 | AAVrh.10 | Intracisternal | Ⅰ | Weill Medical College of Cornell University |
b)척수성 근위축증(SMA) 치료를 위한 AVXS-101
AVXS-101은 AveXis(현재는 노바티스가 소유)에서 개발 중이며, AAV9 벡터를 사용하여 SMA 환자의 운동 뉴런 세포에 SMN1 유전자의 기능적 복사본을 도입하는 것을 목표로 합니다[21]. AVXS-101의 SMN1 트랜스진은 이중 가닥 DNA로 구성되어 있으며, 이는 자연 유전자와 동일한 형태로 유전적 지침을 포함하고 있어 지속적인 SMN 단백질을 신속하게 생성할 수 있으며, 체내에서 보다 효율적인 유전자 치료를 가능하게 합니다. 모든 SMA 1형 환자에서 AVXS-101의 안전성, 내약성 및 운동 기능의 놀라운 개선이 1단계 임상 시험에서 확인되었습니다[51]. 초기 주요 결과를 바탕으로, FDA는 모든 유형의 SMA 치료에 대해 AVXS-101에 희귀 의약품 지정을 부여했으며, SMA 1형 치료를 위한 혁신 치료 지정을 부여했으며, 또한 신속 트랙 지정을 부여했습니다. 마찬가지로, 유럽의약품청(EMA)도 2017년 1월에 SMA 1형 치료를 위한 AVXS-101에 PRIority Medicines(PRIME) 프로그램에 대한 접근을 허용했습니다. 그런 다음 2017년 12월에 AveXis는 또한 STRONG으로 알려진 공개 라벨, 용량 비교, 다기관 1단계 시험을 시작하여 SMA II형 환자의 두 가지 연령 그룹에서 AVXS-101 유전자 치료의 안전성, 최적 용량 및 개념 입증을 평가하기 시작했습니다. 현재 AveXis는 SMA 1형 유아를 대상으로 AVXS-101 유전자 치료의 안전성과 SMA 환자에게 얼마나 잘 작용할 수 있는지를 추가로 이해하기 위한 3단계 시험(NCT03306277)을 진행하고 있으며, 이는 다른 유형의 운동 뉴런 질환을 가진 소아 및 성인 환자에게 새로운 희망을 가져다 줄 수 있습니다.
c)뒤시엔느 근이영양증 치료를 위한 마이크로 디스트로핀을 포함한 AAV
뒤시엔느 근이영양증(DMD)은 디스트로핀 유전자 돌연변이로 인해 발생하는 심각한 유전 질환으로, 소년 및 젊은 남성에서 전신 근육 퇴행 및 괴사를 일으킵니다[22]. 유전자 치료 이론에 따르면, 변이된 디스트로핀 유전자를 기능적 유전자로 교체하면 이 질병을 치료할 수 있습니다[23]. 그러나 디스트로핀 cDNA의 거대한 크기와 신체 전체의 근육 분포는 이 어려운 작업에 대한 큰 장애물입니다. 이러한 장애를 극복하기 위해 연구자들은 매우 축약된 마이크로 디스트로핀 유전자를 개발하고 AAV2.5를 사용하여 전신 유전자 전달을 설계했습니다. AAV2.5는 번역 최적화된 AAV 변종으로, AAV2보다 골격근에서 더 강한 전이를 유도하고 AAV2 중화 항체에 대한 교차 반응성이 낮습니다[11]. 현재까지 전임상 데이터는 혈관 내 AAV 마이크로 디스트로핀 전달이 마우스 및 개와 같은 동물에서 근육 병리를 크게 개선하고 근력 강화하며, 디스트로픽 심근병증을 완화할 수 있음을 시사합니다[24,25]. DMD 환자에 대한 AAV2.5의 1단계 임상 시험은 합리적으로 설계된 AAV 벡터(AAV2.5)가 안전하고 내약성이 좋음을 보여주며, 임상 목표에 가장 적합한 AAV 벡터의 맞춤화를 위한 기초를 마련하고 있습니다[11]. 한편, 마이크로 디스트로핀 유전자를 사용한 AAV2.5의 임상 효과를 평가하기 위해서는 추가 임상 시험이 필요하며, 합성 마이크로 디스트로핀 AAV 벡터를 사용한 전신 DMD 치료의 큰 전망을 보여줍니다[26].
d)혈우병 B 치료를 위한 응고 인자 IX를 포함한 AAV
혈우병 B(HB)는 기능성 응고 인자 IX 단백질(FIX) 결핍으로 인해 발생하는 X-연관 질환입니다[27]. 현재까지 전임상 데이터는 골격근 또는 간에 응고 인자 IX의 AAV 벡터 매개 유전자 전달이 마우스 및 개에서 혈우병 B의 지속적인 교정을 보여주고 있음을 시사합니다[28,29]. FIX cDNA 유전자 전달을 통한 AAV 벡터를 사용한 혈우병 B 치료의 초기 1단계/2단계 임상 시험의 두 가지는 심각한 부작용을 보이지 않았지만, 반대 결과를 보여주었으며, 근육 시험에서는 치료 수준의 FIX를 보이지 않았지만, 혈우병 개와 유사한 치료 효과를 보였습니다[30]. 현재까지 최적화된 응고 인자 IX 구성을 포함한 AAV 벡터의 전신 투여를 통한 혈우병 B 유전자 치료는 많은 환자의 출혈 표현형을 개선하는 등 상당한 진전을 이루었습니다[31]. 그러나 환자에서 지속적인 유전자 치료를 위해서는 과제가 남아 있으며, AAV 벡터, 트랜스진 카세트 및 교정 전략의 최적화를 통해 FIX의 장기 발현을 개선하기 위한 노력이 필요합니다.
3. AAV 벡터 매개 유전자 전달의 장점과 단점
a) AAV 매개 유전자 전달의 장점
AAV는 유전자 치료 및 아이소제닉 인간 질병 모델의 생성에 매우 매력적인 후보로 발전했습니다.
1) 우수한 생물 안전 등급. 현재까지 야생형 AAV가 체내에서 질병을 일으키는 것으로 알려져 있지 않으며, 대부분의 AAV 게놈 요소를 제거한 후 재조합 AAV 유전자 전달의 추가 보안이 보장됩니다.
2) 낮은 면역원성. AAV는 체내에서 매우 경미한 면역 반응을 일으키며, 유전자 전달 중 명백한 병원성의 부족을 추가로 지원합니다.
3) 넓은 감염 범위. AAV는 체내에서 분열 중 및 정지 중인 세포 모두에 감염할 수 있으며, 다양한 세포 유형에 유전자를 전달할 수 있습니다.
4) 안정된 발현. 장기간 체내에서의 유전자 전달은 AAV에 의해 매개될 수 있습니다.
b) AAV 매개 유전자 전달의 단점
아데노바이러스는 많은 질병 치료에 큰 혜택을 제공하지만, 몇 가지 단점도 있습니다.
1) 주요 단점은 벡터의 클로닝 용량이 제한되어 있다는 점(4.7kb 미만)으로, 이는 큰 유전자의 유전자 전달에 대한 사용을 제한합니다.(표3)[32].
2) 비인간 영장류(NHP) 및 인간에서 AAV에 대한 중화 항체의 생성은 AAV 매개 유전자 치료의 치료 효과를 약화시킬 수 있습니다[33].
| Comparison | Retrovirus | Lentivirus | Adenovirus | AAV |
| Genome | ss RNA | ss RNA | ds DNA | ss DNA |
| Integration | Yes | Yes | No | No |
| Packaging Capacity | 3kb | 4kb | 5.5kb | 2kb |
| Time to peak expression | 72h | 72h | 36h-72h | Cell: 7 days; Animals: 2 weeks |
| Sustainable time | About 3 weeks | Stable expression | Transient expression | > 6 months |
| Cell Type | Most Dividing | Most Dividing/Non-Dividing Cells | Most Dividing/Non-Dividing Cells | Most Dividing/Non-Dividing Cells |
| Titer | 10^7 TU/ml | 10^8 TU/ml | 10^11 PFU/ml | 10^12 vg/ml |
| Animal experiment | Suitable | Low efficiency | Lowest efficiency | Most suitable |
| Immune Response | High | Medium | Medium | Ultra-low |
4. AAV 게놈 구조 (ITR, Rep, Cap, VP1, VP2, VP3) 및 AAV 바이러스 조립
AAV 쉘의 직경은 약 25nm이며, 4.7킬로베이스의 단일 가닥 DNA 게놈을 캡시드에 포장합니다. 게놈은 145bp의 반전 말단 반복 서열(ITR)로 둘러싸인 두 개의 큰 오픈 리딩 프레임(ORF)으로 구성되어 있으며, 이들은 AAV 게놈 복제 및 AAV 포장에 필요한 유일한 시스 작용 요소입니다. 왼쪽 ORF는 4개의 복제 단백질(Rep40, Rep52, Rep68, Rep78)을 코딩하며, 이는 AAV 게놈 내에서 AAV 캡시드 형성 시작을 조절하고 특이적 통합을 담당합니다. 오른쪽 ORF는 바이러스 구조 단백질(VP1, VP2, VP3)을 코딩하며, 이들은 상호 작용하여 각각 60개의 소단위로 구성된 정이십면체 비리온 쉘을 조립합니다(그림 1).
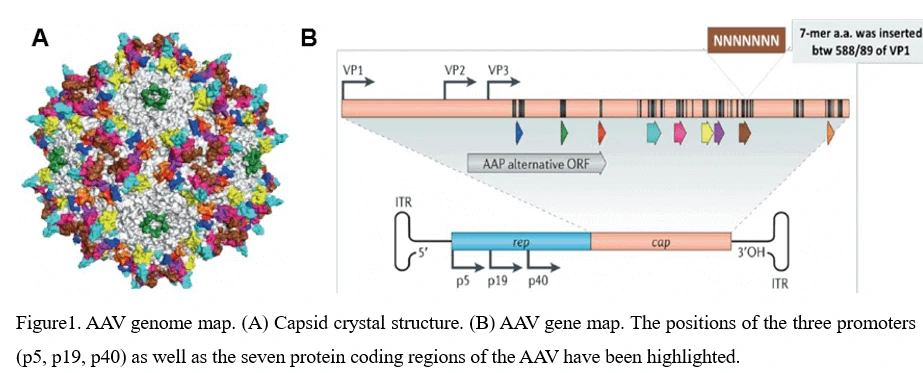
5. AAV 바이러스의 생애 주기 - 감염에서 재생까지
AAV는 다음 단계들을 통해 세포를 트랜스듀스합니다: (1) 바이러스가 세포 표면 수용체/공수용체에 결합, (2) 바이러스의 세포 내 흡수, (3) 엔도솜 구획을 통한 바이러스의 세포 내 이동, (4) 엔도솜 탈출, (5) 바이러스의 세포핵으로의 이동 및 핵으로의 수송, (6) 비리온의 탈피, (7) 바이러스 게놈이 단일 가닥에서 이중 가닥 게놈으로 변환되어 코딩된 유전자를 발현할 수 있게 되는 단계[34-36]. AAV는 폴리메라아제를 코딩할 수 없으므로, AAV는 자신의 게놈을 복제하기 위해 세포의 폴리메라아제 활성에 의존합니다[37]. 아데노바이러스와 같은 보조 바이러스의 존재는 야생형 AAV의 유전자 발현 및 복제를 촉진하는 데 필수적입니다(그림 2A). 보조 바이러스가 없으면, P5 프로모터의 YY1 억제로 인해 Rep68/Rep78의 발현이 제한되어 AAV 게놈 복제 및 유전자 발현이 억제되고, AAV 염색체 통합이 시작됩니다(그림 2B)[38]. AAV는 아데노 관련 바이러스 통합 사이트 1(AAVS1)이라고 하는 게놈 사이트에 특이적으로 통합함으로써 잠복성을 확립합니다. 이 사이트는 염색체 19(q13.4)에 위치한 4kb 영역입니다.
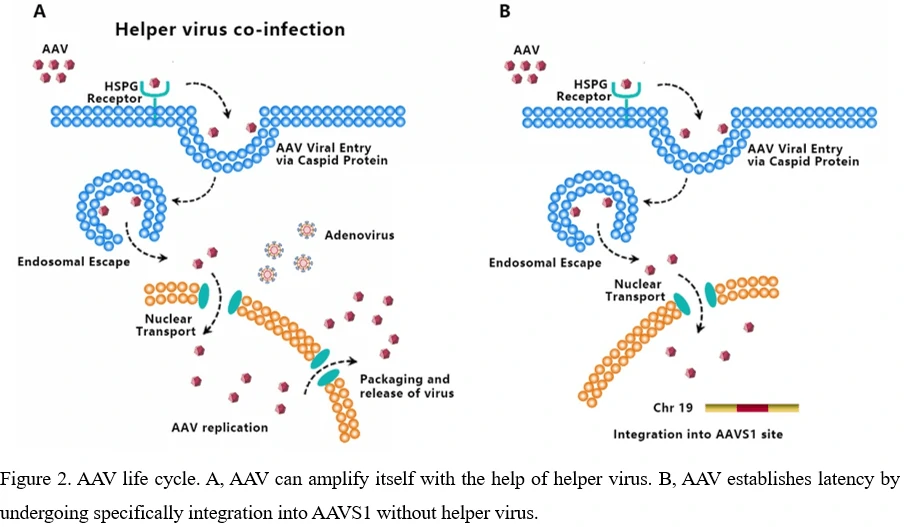
현재까지 AAV와 관련된 알려진 질병은 없지만, AAV는 많은 동물 종의 조직에서 검출되었습니다. 혈청학적 연구는 대부분의 사람들이 어린 시절과 청소년기에 야생형 AAV에 노출된다고 보여주며, 성인의 항체 역가 유병률은 60%를 초과하지만, 유해한 영향이나 용해성 감염은 관찰되지 않았습니다[39,40].
6. AAV 혈청형 및 AAV 조직 특이적 애호성
지난 수십 년 동안 다양한 AAV 혈청형이 확인되었으며, 다양한 애호성이 밝혀졌습니다. 현재까지 12개의 AAV 혈청형과 100개 이상의 AAV 변형체가 아데노바이러스 주식이나 인간/비인간 영장류 조직에서 분리되었습니다. 그중 AAV2, AAV3, AAV5, AAV6은 인간 세포에서 발견되었고, AAV1, AAV4, AAV7, AAV8, AAV9, AAV10(AAVrh10), AAV11, AAV12는 비인간 영장류 샘플에서 발견되었습니다[41]. 다른 혈청형 간의 게놈 분기는 바이러스 캡시드의 고변이 영역(HVR)에 가장 집중되어 있으며, 이는 조직 애호성을 결정할 수 있습니다[42]. 바이러스 캡시드 외에도, AAV 벡터의 조직 애호성은 세포 표면 수용체, 세포 내 흡수, 세포 내 처리, 벡터 게놈의 핵으로의 수송, 탈피 및 이중 가닥 DNA 변환에 의해 영향을 받습니다[3]. 조직의 트랜스덕션을 효과적으로 구현하거나 AAV 애호성을 특정 조직에 제한하기 위해, 연구자들은 유전자 치료를 수행하기 위해 사용자 정의된 AAV 캡시드를 공학적으로 설계하여 모자이크 AAV 벡터나 키메라 AAV 벡터를 개발했습니다[43,44].
a)AAV 혈청형 2 (AAV2)
AAV 혈청형 2 (AAV2)는 최초로 분리된 AAV로, 가장 연구가 많이 이루어진 AAV 혈청형입니다. AAV2는 골격근[45], 뉴런[46], 혈관 평활근 세포[47], 간세포[48]에 자연 애호성을 가지고 있습니다. AAV2는 세 가지 수용체를 가지며, 그 중 헤파란 황산 프로테오글리칸(HSPG)은 AAV 입자를 포획하고 감염 효율을 저하시킵니다[49]. 반면, αVβ5 인테그린 및 섬유아세포 성장 인자 수용체 1(FGFR-1)은 수용체 매개 엔도사이토시스를 통해 AAV가 세포에 들어갈 수 있도록 하는 공동 수용체로 작용합니다[50-52]. AAV2는 현재 건강한 세포에 영향을 미치지 않고 난소 암(OvCa)과 같은 암 치료에 사용되고 있습니다[53].
b)AAV 혈청형 8 (AAV8) 및 AAV 혈청형 9 (AAV9)
AAV2 외에도, 가장 널리 사용되는 AAV 혈청형은 AAV8 및 AAV9입니다. AAV8은 간으로 유전자를 전달하는 강력한 벡터로, 대부분의 다른 혈청형보다 더 높은 효율로 다양한 표적 기관에 유전자를 전달하는 유망한 연구 도구입니다. 연구에 따르면, 전신 주사 후 간, 골격근 및 심장의 효율적인 트랜스덕션이 감지되었습니다[54]. 더 중요한 것은, AAV8의 단일 꼬리 정맥 주사가 어떤 용량에서도 문맥 주사만큼 효율적이며, 고용량의 AAV8이 전신의 골격근을 트랜스덕션하고, 횡격막, 전체 심장 근육 및 췌장, 평활근 및 뇌를 상당한 수준으로 트랜스덕션했다는 것입니다[55]. AAV2와 비교하여, AAV9는 훨씬 더 효율적인 광범위한 트랜스덕션 프로파일을 보여줍니다[56]. 또한, AAV9는 혈액뇌장벽(BBB)을 우회할 수 있는 능력이 있어, 혈관 내 투여가 광범위한 CNS 유전자 발현을 달성하기 위한 비침습적 전달 경로로 사용될 수 있습니다. 더 나아가, AAV9의 정맥 내 유전자 도입은 동물 모델에서 몇 가지 질병에 대해 유망한 결과를 보여주고 있으며, 이러한 연구는 리소좀 축적 장애 및 운동 뉴런 질환 등에서 첫 임상 시험으로 이어지고 있습니다[57].
c)다른 AAV 혈청형
오늘날에는 12가지 AAV 혈청형이 유전자 전달 벡터로 설계되었습니다. 벡터 타이터와 용량, 프로모터 및 트랜스진 사이의 연구 간 변동으로 인해 AAV 혈청형의 조직 애호성을 해석하는 것은 어려울 수 있습니다. 주요 조직 및 세포 유형에서 트랜스덕션 효율의 일반적인 계층이 표 1 및 표 2에 확립되었습니다. 예를 들어, AAV2는 중추 신경계, 간, 근육 및 폐를 포함한 여러 조직 유형을 중간 정도로 트랜스덕션할 수 있습니다. 유사하게, CNS 내에서 AAV1 및 AAV5는 주입된 모든 영역에서 AAV2보다 높은 트랜스덕션 빈도를 보여줍니다[58,59]. 한편, AAV4는 측뇌실대의 성상 세포 및 상피 세포와 같은 특정 세포 유형을 트랜스덕션하는 것으로 보입니다[60]. 골격근 세포에서는 AAV1, AAV6 및 AAV7이 매우 높은 트랜스덕션률을 보여주는 것으로 보고되었습니다[56,61-63]. 한편, AAV8은 간세포뿐만 아니라 다른 장기에서도 매우 높은 효율로 트랜스덕션 능력을 보여줍니다[44,61,64]. 골격근 세포에 추가하여, AAV6는 AAV2와 비교하여 마우스 폐의 기도 상피 세포의 더 효율적인 트랜스덕션을 매개하는 것으로 보고되었으며, 이는 AAV6가 AAV2보다 낮은 면역원성을 가지고 있어 낭포성 섬유증과 같은 폐 질환의 유전자 치료에 대해 AAV2보다 더 큰 이점을 제공할 수 있습니다[44,61].
| AAV Serotype | Tissue tropism | |||||||
| CNS | Retina | Lung | Liver | Pancreas | Kidney | Heart | Muscle | |
| AAV1 | √ | √ | √ | √ | √ | |||
| AAV2 | √ | √ | √ | |||||
| AAV3 | √ | √ | √ | √ | ||||
| AAV4 | √ | √ | √ | |||||
| AAV5 | √ | √ | √ | √ | ||||
| AAV6 | √ | √ | √ | √ | √ | |||
| AAV7 | √ | √ | ||||||
| AAV8 | √ | √ | √ | √ | ||||
| AAV9 | √ | √ | √ | √ | √ | |||
| AAV-DJ | √ | √ | √ | √ | ||||
| AAV-DJ/8 | √ | √ | √ | |||||
| AAV-Rh10 | √ | √ | √ | √ | √ | |||
| AAV-retro | √ | √ | √ | |||||
| AAV-PHP.B | √ | √ | √ | |||||
| AAV8-PHP.eB | √ | √ | ||||||
| AAV-PHP.S | √ | √ | √ | |||||
| Cell Line | AAV1 | AAV2 | AAV3 | AAV4 | AAV5 | AAV6 | AAV8 | AAV9 | AAV-DJ | AAV-DJ/8 |
| Huh-7 | 13 | 100 | 2.5 | 0 | 0.1 | 10 | 0.7 | 0 | 500 | 0.2 |
| HEK293 | 25 | 100 | 2.5 | 0.1 | 0.1 | 5 | 0.7 | 0.1 | 500 | 0.3 |
| Hela | 3 | 100 | 2 | 0.1 | 6.7 | 1 | 0.2 | 0.1 | 667 | 0.2 |
| HepG2 | 3 | 100 | 16.7 | 0.3 | 1.7 | 5 | 0.3 | ND | 1250 | 0.5 |
| Hep1A | 20 | 100 | 0.2 | 1 | 0.1 | 1 | 0.2 | 0 | 400 | 0.1 |
| 911 | 17 | 100 | 11 | 0.2 | 0.1 | 17 | 0.1 | ND | 500 | 0 |
| CHO | 100 | 100 | 14 | 1.4 | 333 | 50 | 10 | 1 | 25000 | 5 |
| COS | 33 | 100 | 33 | 3.3 | 5 | 14 | 2 | 0.5 | 500 | 0.3 |
| MeWo | 10 | 100 | 20 | 0.3 | 6.7 | 10 | 1 | 0.2 | 2857 | 1 |
| NIH3T3 | 10 | 100 | 2.9 | 2.9 | 0.3 | 10 | 0.3 | ND | 500 | 0.1 |
| A549 | 14 | 100 | 20 | ND | 0.5 | 10 | 0.5 | 0.1 | 1000 | 0.1 |
| HT1180 | 20 | 100 | 10 | 0.1 | 0.3 | 33 | 0.5 | 0.1 | 333 | 0.2 |
| Monocytes | 1111 | 100 | ND | ND | 125 | 1429 | ND | ND | 100 | ND |
| Immature DC | 2500 | 100 | ND | ND | 222 | 2857 | ND | ND | 200 | ND |
| Mature DC | 2222 | 100 | ND | ND | 333 | 3333 | ND | ND | 100 | ND |
7. AAV 벡터 시스템 (AAV Vector System)
a)rAAV 벡터 시스템 소개
야생형 AAV는 인간 질병과 관련이 없지만 자연적으로 결함이 있으며 AAV 복제를 위해 보조 아데노바이러스 또는 단순포진바이러스(HSV) 공동 감염이 필요하기 때문에 재조합 AAV(rAAV)는 유전자 치료의 매력적인 벡터가 되었습니다. 1984년, rAAV는 바이러스 게놈을 트랜스유전자로 대체하여 처음 사용되었으며, 이후 아데노바이러스에 감염된 세포에 트랜스펙션되어 rAAV가 생성되었습니다.
전통적으로, 임상 시험에서 사용된 rAAV 벡터는 AAV 반전 말단 반복(ITR)으로 둘러싸인 치료 유전자를 포함한 플라스미드를 AAV 포장 플라스미드 AAV-RC(AAV 복제 및 AAV 캡시드) 및 pHelper(AAV 보조 플라스미드)와 함께 공동 트랜스펙션하여 준비되었습니다. 아데노바이러스 보조 인자, 예를 들어 E1A, E1B, E2A, E4ORF6 및 VA RNA는 세 번째 보조 플라스미드에 의해 제공됩니다. 일반적으로 사용되는 AAV 생산 세포인 HEK293 세포는 이미 E1A/E1B 유전자를 포함하고 있기 때문에, 보조 플라스미드에 의해 제공되는 것은 E2A, E4ORF6 및 VA RNA뿐입니다.
b)보조 없는 rAAV 시스템
현재 rAAV 생산 방법은 HEK293 세포와 같은 숙주 세포에 AAV 생산에 필요한 모든 요소를 일시적으로 트랜스펙션하는 아데노바이러스 없는 방법에 기반하고 있습니다. 이는 도표 3에 나와 있는 것처럼 AAV 생산 세포에 3개의 플라스미드를 공동 트랜스펙션하는 것을 포함합니다.
1. AAV-GOI: 관심 있는 유전자(GOI)를 운반하는 AAV ITR 포함 플라스미드;
2. AAV-RC: Rep 및 Capsid 유전자를 운반하는 AAV 혈청형 플라스미드;
3. pHelper: 아데노바이러스에서 분리된 보조 유전자를 제공하는 AAV 보조 플라스미드.
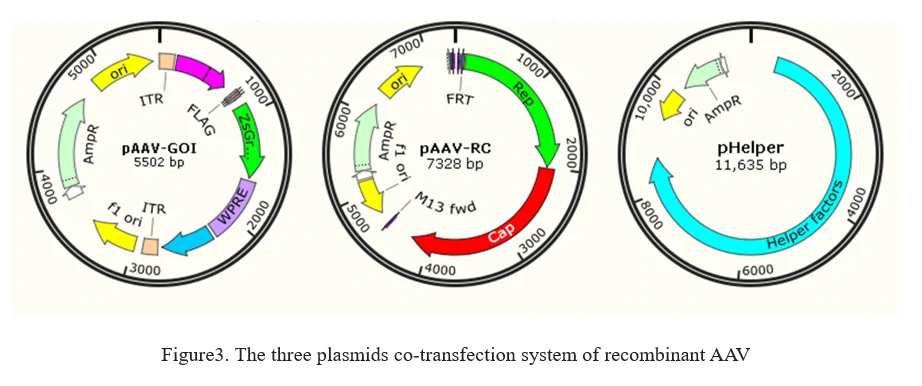
8. AAV 엔지니어링 (AAV 캡시드 진화)
AAV 캡시드 재설계의 세부 사항 보기>>
자연계에서는 100개 이상의 AAV 혈청형 변종이 발견되었지만, rAAV 생산을 위한 중요한 진전이 이루어졌으며, 동물 및 영장류의 일부 조직 및 세포 유형에 대한 트랜스덕션 효율 및 특이성이 낮습니다. AAV에 의한 비표적 전달은 높은 용량을 필요로 하며, 잠재적인 독성, 문제 있는 제조 부담 및 최적이 아닌 효과를 초래할 수 있습니다. 따라서 AAV를 벡터로 개발하는 중요한 영역은 rAAV 매개 유전자 전달 효율 및 특이성을 높이기 위해 세포 트로피즘을 변경하는 엔지니어링과 관련이 있습니다. 다양한 AAV 혈청형 중에서 트랜스덕션 효율의 변동은 대상 세포에서 각 수용체의 함량 차이로 인해 발생할 수 있습니다.
AAV 전달 효율 및 특이성을 향상시키기 위한 다양한 전략이 개발되었습니다. 방법론적으로, AAV 트로피즘 및 특이성을 향상시키는 방법은 두 가지 범주로 나뉩니다. 하나는 서로 다른 바이러스 간의 단백질 조립 및 재조합으로 하이브리드 rAAV를 생성할 수 있습니다. 다른 하나는 다양한 방법으로 AAV 캡시드 단백질에 재조합, 재설계 또는 무작위 돌연변이를 도입하여 AAV 혈청형의 변이를 인위적으로 증가시키고 적절한 AAV 혈청형을 선별하는 것입니다.
a)하이브리드 rAAV 벡터
하이브리드 rAAV 벡터를 생성하는 데 일반적으로 사용되는 접근 방식은 트랜스캡시데이션입니다. 이는 다른 혈청형의 캡시드에 ITR을 포장하는 과정으로, 하이브리드의 조직 트로피즘을 결정할 수 있습니다. 예를 들어, 위에서 논의한 보조 없는 시스템에 기반하여 rAAV2/5를 생성하려면, AAV 포장 플라스미드 AAV-RC는 pRep2/Cap5이어야 합니다. 즉, Rep 유전자는 AAV2에서 파생되고 캡시드 유전자는 AAV5에서 파생됩니다. 포장 계획은 AAV2 생산을 위한 위의 접근 방식과 동일합니다. 생성된 rAAV는 rAAV2/5라고 하며, 이 바이러스의 조직 트로피즘은 AAV5와 동일하다고 가정됩니다.
b)AAV 혁명
AAV를 진화시키는 주요 방법은 두 가지입니다. 하나는 합리적 설계이고, 다른 하나는 직접 진화입니다 (도표4 참조).
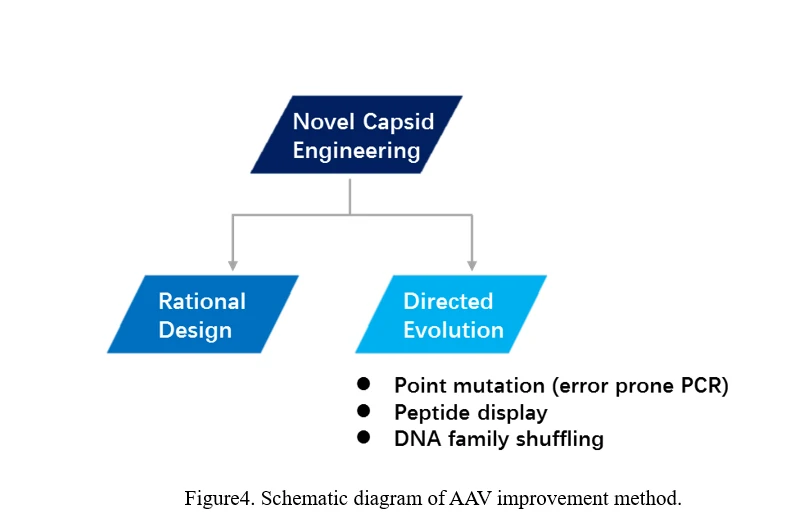
합리적 설계
합리적 설계 AAV 캡시드의 일반적인 방법 중 일부는 전달 메커니즘에 대한 지식과 AAV 구조 분석을 기반으로 합니다[65]. 다음과 같이 나열됩니다.
(1) AAV 캡시드의 티로신 잔기의 인산화는 유비퀴틴화를 일으키고 AAV 비리온의 프로테아좀 분해를 촉진하여 부위 특이적 변이 도입에 의해 티로신을 페닐알라닌으로 변이시키는 벡터의 생성에 이르게 합니다[66].
(2) AAV2 표면에 마우스 IgG2a 항체의 도킹 부위를 분석하여 입체적으로 접근 가능한 후보 위치를 결정한 다음, 광범위한 부위 특이적 변이 도입을 통해 in vitro에서 항체에 의한 중화를 줄이는 변이체를 개발했습니다[67].
(3) AAV 캡시드에 고친화성 리간드를 도입하여 대체 세포 표면 수용체에 결합하고 바이러스 트로피즘을 제한하거나 다시 방향을 바꿀 수 있습니다[68].
AAV 직접 진화
전통적인 직접 진화 과정은 먼저 에러 프론 PCR, 펩타이드 디스플레이 또는 DNA 패밀리 셔플링으로 라이브러리를 생성합니다. 그런 다음, 이 AAV 바이러스 라이브러리를 풀로 패키징하고 정제하여, in vitro 또는 in vivo에서 일정한 압력 하에 선택합니다. 표적 세포 또는 조직에 감염된 후, 바이러스는 아데노바이러스 매개 복제 또는 PCR 증폭에서 회복됩니다. 3회 이상의 선택 후, 높은 감염력과 특이성을 가진 AAV 캡시드 종이 농축됩니다 (도표5 참조) [69].
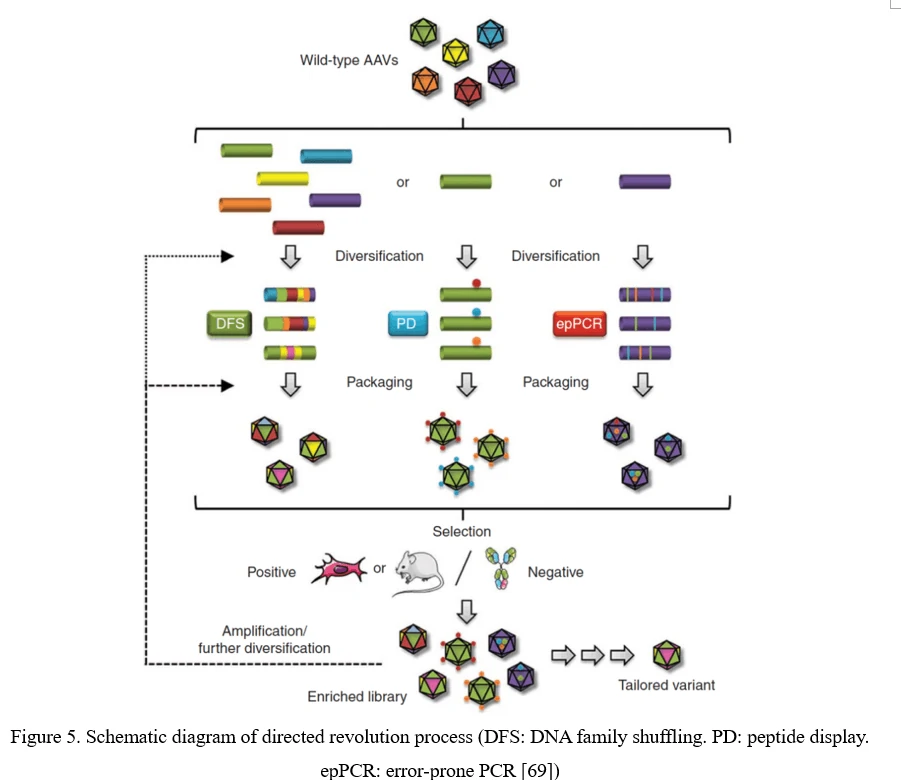
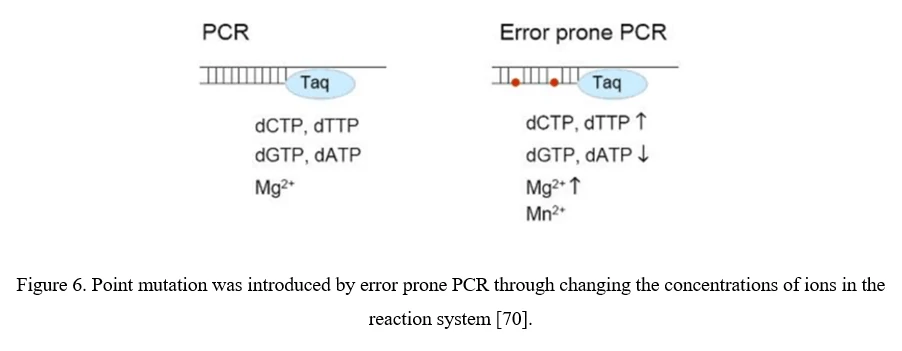
점 돌연변이 (에러 프론 PCR)
AAV 다양화를 위한 가장 간단한 전략은 AAV 바이러스 캡시드의 개별 잔기를 부위 특이적 또는 무작위 방식으로 돌연변이시켜, 도입된 아미노산 변화가 AAV 벡터의 필수 특성을 변경할 수 있기를 기대하는 것입니다. 무작위 돌연변이는 에러 프론 PCR을 통해 AAV 캡시드를 암호화하는 서열에 도입할 수 있습니다 (도표 6 참조).
점 돌연변이는 AAV 캡시드를 암호화하는 서열에 쉽게 도입될 수 있지만, 여전히 문제는 존재합니다. 1) 일반적으로 AAV 돌연변이 중 유익한 것은 0.01-1%에 불과합니다. 2) 단일 AAV 캡시드 내의 여러 돌연변이의 모든 조합을 다루는 클론 수는 기술적으로 가능성을 초과합니다. AAV 캡시드의 특정 영역, 특히 세포 수용체 및 항체와 상호작용할 가능성이 높은 표면에 노출된 영역 및 AAV 캡시드의 돌출부에 초점을 맞추는 것이 더 유용합니다[70].
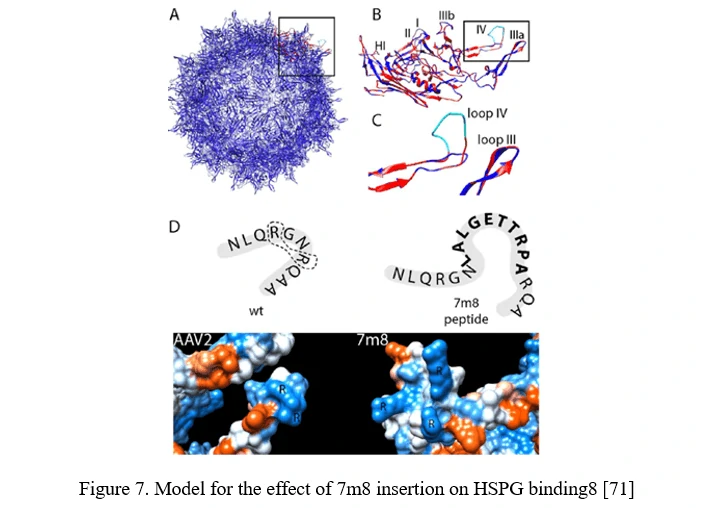
펩타이드 디스플레이
AAV 캡시드 표면에 새로운 수용체 결합 요소를 삽입하여 특정 세포 유형에 특이적으로 발현되는 수용체에 대한 친화성을 제공할 수 있습니다. 이 AAV 펩타이드 디스플레이 전략의 성공을 극대화하려면, 펩타이드의 표면 노출을 매개하는 AAV 캡시드 부위를 활용하는 것이 중요합니다.
AAV2의 경우, HSPG에 결합하는 데 필요한 두 개의 중요한 잔기 중 하나인 알기닌 588(R588) 앞이나 뒤에 삽입하여 이를 달성할 수 있습니다. AAV2-7m8 변이체에서는 7m8이 HSPG 결합 모티프를 방해하고, 알기닌을 분리합니다 (도표 7 참조) [71].
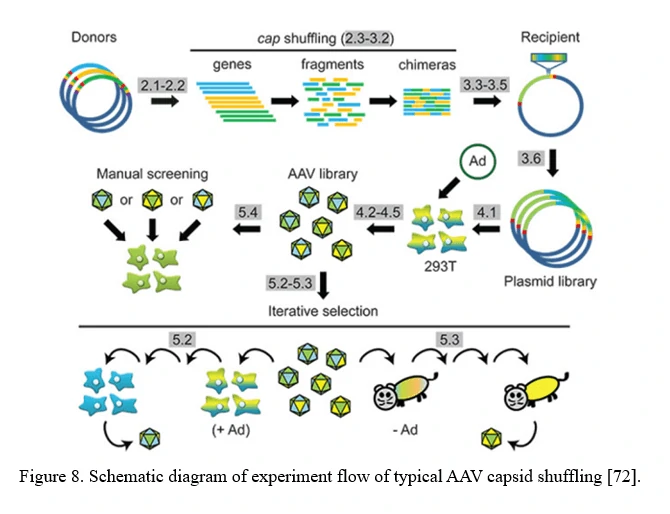
AAV 패밀리 셔플링 (AAV 캡시드의 DNA 셔플링)
키메라 캡시드를 암호화하는 라이브러리는 AAV 패밀리 셔플링으로 생성될 수 있습니다 (도표 8 참조). 다양한 AAV 캡시드 유전자 단편들이 부분적인 상동성(대부분의 AAV 혈청형의 경우 일반적으로 >80%)을 기반으로 재조립됩니다. 이 라이브러리에는 세포 트로피즘과 중화 항체 저항성에서 광범위한 다양성을 가진 키메라가 포함됩니다.
이 접근 방식은 또한 새로운 기능을 혼합하고 합리적으로 설계된 AAV 캡시드 변이체에서 기능을 활용하여, 새롭고 무한한 수의 변이체를 만들 수 있는 잠재력을 가지고 있습니다[72].
9. AAV 벡터 트랜스덕션 - AAV 벡터 유전자 전달 in vivo
정상적인 조직이나 기관, 예를 들어 심장, 간, 신장, 유방, 췌장, 난소, 뇌, 눈, 골격근, 지방 조직 등에 대해 GeneMedi는 마우스와 랫의 조직 감염에 최적의 AAV 혈청형, 유전자 전달 방법 및 주입량을 체계적으로 정리했습니다. 다양한 기관에 대한 권장 AAV 유전자 전달 방법은 표 5에 나와 있습니다.
| Infection organ | Recommended serotype | Injection route | Animal | Injection volume (μl) |
| Heart | AAV9 | Multiple points in situ | Rat | 10-15/point, 3-5 points |
| Mouse | 10-15/point, 3-5 points | |||
| Tail vein | Rat | 250 (200g body weight) | ||
| Mouse | 100 | |||
| Liver | AAV8 or AAV9 | Tail vein | Rat | 200 (200g body weight) |
| Mouse | 100 | |||
| Whole brain | AAV-PHP.eB AAV-PHP.B | Tail vein | Rat | 200 (200g body weight) |
| Mouse | 100 | |||
| Lateral ventricle | AAV9 | Stereotactic | Rat | 1-5 |
| Mouse | 1-5 | |||
| Brain tissue | AAV9 | Stereotactic | Rat | 2-3 |
| Mouse | 1-2 | |||
| Fat | AAV9 | Intraperitoneal injection for intraperitoneal fat | Rat | 300 |
| Mouse | 150-200 | |||
| in situ injection for subcutaneous fat | Rat | 10-15/point, 3-5 points | ||
| Mouse | 10-15/point, 3-5 points | |||
| Skeletal muscle | AAV1 or AAV9 | In situ injection | Rat | 10-15/point, 3-5 points |
| Mouse | 10-15/point, 3-5 points | |||
| Eyes | AAV2, AAV10 or AAV-DJ | vitreous chamber injection | Rat | 3-5 |
| Mouse | 1-3 | |||
| subretinal space injection | Rat | 1-2 | ||
| Mouse | 1-2 | |||
| Lung | AAV6 | Intratracheal injection | Rat | 100 (200g weight) |
| Mouse | 50-75 | |||
| Kidney | AAV2 or AAV9 | Renal pelvis injection | Rat | 10-15/point, 3-5 points |
| Mouse | 10-15/point, 3-5 points | |||
| Intestine | AAV1 or AAV5 | Enema | Rat | 200 (200g weight) |
| Mouse | 100 |
AAV의 in vivo 동물 주사 프로토콜에 대한 자세한 정보는 AAV 사용자 매뉴얼에서 확인할 수 있습니다.
10. 아데노-관련 바이러스 (AAV 벡터) - 생산 프로토콜, 가이드라인 및 참고 문헌
AAV 생산 프로토콜--Genemedi
1. AAV 플라스미드 구성
관심 유전자는 ITR/MCS를 포함한 AAV 벡터 중 하나에 클로닝되어 AAV-GOI를 생성합니다. AAV 바이러스 플라스미드의 순도와 RNAse 오염 물질을 고려해야 합니다.
2. AAV 패키징
재조합 AAV 바이러스 플라스미드 AAV-GOI는 AAV 헬퍼 플라스미드 pHelper(아데노바이러스 유래 유전자를 운반하는) 및 AAV-RC(AAV-2 복제 및 캡시드 유전자를 운반하는)와 함께 AAV-293 세포에 공동 트랜스펙션되며, 이들은 AAV 복제 및 AAV-293 세포 내에서의 패키징에 필요한 모든 트랜스-작용 인자를 제공합니다.
3. AAV 입자의 수확
세포를 수집하고 세포 펠릿을 냉동/해동하여 AAV 바이러스를 방출합니다.
4. AAV 정제
불순한 AAV 준비물에서 오염 물질을 분리하기 위해 그라데이션 초원심분리를 사용하여 AAV 바이러스를 정제합니다.
5. AAV 티터 검출
AAV ITR을 대상으로 하는 프라이머를 사용하여 실시간 정량 PCR(QPCR)로 AAV 티터를 결정합니다. 티터 값은 알려진 농도의 플라스미드 샘플의 표준 곡선과 비교하여 식별됩니다.
6. AAV의 품질 관리
AAV 바이러스의 티터 검출 후, 293T, CHO 등의 세포를 감염시켜 유전자 발현을 테스트하여 동물 실험 전 감염 활성을 평가해야 합니다. 세포에서 AAV 매개 유전자 트랜스덕션을 위한 MOI는 10^4에서 10^5 범위 내에서 제어됩니다.
Adeno-associated virus (AAV vector) - Guidelines
| NIH Guidelines for Adeno-Associated (AAV) Lentivirus and Adenovirus | Guidance for Gene Therapy Clinical trials-FDA | Human Gene Therapy for Hemophilia |
| Human Gene Therapy For Rare Diseases | Human Gene Therapy for Retinal Disorders |
1.
Atchison RW, BC Casto and WM Hammon. (1965). Adenovirus-Associated Defective Virus Particles. Science 149:754-6.
2.
Hoggan MD, NR Blacklow and WP Rowe. (1966). Studies of small DNA viruses found in various adenovirus preparations: physical, biological, and immunological characteristics. Proc Natl Acad Sci U S A 55:1467-74.
3.
Wu Z, A Asokan and RJ Samulski. (2006). Adeno-associated virus serotypes: vector toolkit for human gene therapy. Mol Ther 14:316-27.
4.
Vectors used in gene therapy clinical trials. The Journal of Gene Medicine Online Library. [Online] Updated Nov 2017. http://www.abedia.com/wiley/vectors.php.
5.
Zsigmond E, K Kobayashi, KW Tzung, L Li, Y Fuke and L Chan. (1997). Adenovirus-mediated gene transfer of human lipoprotein lipase ameliorates the hyperlipidemias associated with apolipoprotein E and LDL receptor deficiencies in mice. Hum Gene Ther 8:1921-33.
6.
Passini MA, J Bu, AM Richards, CM Treleaven, JA Sullivan, CR O'Riordan, A Scaria, AP Kells, L Samaranch, W San Sebastian, T Federici, MS Fiandaca, NM Boulis, KS Bankiewicz, LS Shihabuddin and SH Cheng. (2014). Translational fidelity of intrathecal delivery of self-complementary AAV9-survival motor neuron 1 for spinal muscular atrophy. Hum Gene Ther 25:619-30.
7.
Stieger K and B Lorenz. (2014). [Specific gene therapy for hereditary retinal dystrophies - an update]. Klin Monbl Augenheilkd 231:210-5.
8.
Trapani I, P Colella, A Sommella, C Iodice, G Cesi, S de Simone, E Marrocco, S Rossi, M Giunti, A Palfi, GJ Farrar, R Polishchuk and A Auricchio. (2014). Effective delivery of large genes to the retina by dual AAV vectors. EMBO Mol Med 6:194-211.
9.
Doi K and Y Takeuchi. (2015). Gene therapy using retrovirus vectors: vector development and biosafety at clinical trials. Uirusu 65:27-36.
10.
Duncan GA, N Kim, Y Colon-Cortes, J Rodriguez, M Mazur, SE Birket, SM Rowe, NE West, A Livraghi-Butrico, RC Boucher, J Hanes, G Aslanidi and JS Suk. (2018). An Adeno-Associated Viral Vector Capable of Penetrating the Mucus Barrier to Inhaled Gene Therapy. Mol Ther Methods Clin Dev 9:296-304.
11.
Bowles DE, SW McPhee, C Li, SJ Gray, JJ Samulski, AS Camp, J Li, B Wang, PE Monahan, JE Rabinowitz, JC Grieger, L Govindasamy, M Agbandje-McKenna, X Xiao and RJ Samulski. (2012). Phase 1 gene therapy for Duchenne muscular dystrophy using a translational optimized AAV vector. Mol Ther 20:443-55.
12.
Nathwani AC, EG Tuddenham, S Rangarajan, C Rosales, J McIntosh, DC Linch, P Chowdary, A Riddell, AJ Pie, C Harrington, J O'Beirne, K Smith, J Pasi, B Glader, P Rustagi, CY Ng, MA Kay, J Zhou, Y Spence, CL Morton, J Allay, J Coleman, S Sleep, JM Cunningham, D Srivastava, E Basner-Tschakarjan, F Mingozzi, KA High, JT Gray, UM Reiss, AW Nienhuis and AM Davidoff. (2011). Adeno-associated virus vector-mediated gene transfer in hemophilia B. N Engl J Med 365:2357-65.
13.
Jessup M, B Greenberg, D Mancini, T Cappola, DF Pauly, B Jaski, A Yaroshinsky, KM Zsebo, H Dittrich, RJ Hajjar and I Calcium Upregulation by Percutaneous Administration of Gene Therapy in Cardiac Disease. (2011). Calcium Upregulation by Percutaneous Administration of Gene Therapy in Cardiac Disease (CUPID): a phase 2 trial of intracoronary gene therapy of sarcoplasmic reticulum Ca2+-ATPase in patients with advanced heart failure. Circulation 124:304-13.
14.
LeWitt PA, AR Rezai, MA Leehey, SG Ojemann, AW Flaherty, EN Eskandar, SK Kostyk, K Thomas, A Sarkar, MS Siddiqui, SB Tatter, JM Schwalb, KL Poston, JM Henderson, RM Kurlan, IH Richard, L Van Meter, CV Sapan, MJ During, MG Kaplitt and A Feigin. (2011). AAV2-GAD gene therapy for advanced Parkinson's disease: a double-blind, sham-surgery controlled, randomised trial. Lancet Neurol 10:309-19.
15.
Mease PJ, N Wei, EJ Fudman, AJ Kivitz, J Schechtman, RG Trapp, KF Hobbs, M Greenwald, A Hou, SA Bookbinder, GE Graham, CW Wiesenhutter, L Willis, EM Ruderman, JZ Forstot, MJ Maricic, KH Dao, CH Pritchard, DN Fiske, FX Burch, HM Prupas, P Anklesaria and AE Heald. (2010). Safety, tolerability, and clinical outcomes after intraarticular injection of a recombinant adeno-associated vector containing a tumor necrosis factor antagonist gene: results of a phase 1/2 Study. J Rheumatol 37:692-703.
16.
Evans CH, SC Ghivizzani and PD Robbins. (2018). Gene Delivery to Joints by Intra-Articular Injection. Hum Gene Ther 29:2-14.
17.
Gupta PR and RM Huckfeldt. (2017). Gene therapy for inherited retinal degenerations: initial successes and future challenges. J Neural Eng 14:051002.
18.
Polinski NK, SE Gombash, FP Manfredsson, JW Lipton, CJ Kemp, A Cole-Strauss, NM Kanaan, K Steece-Collier, NC Kuhn, SL Wohlgenant and CE Sortwell. (2015). Recombinant adenoassociated virus 2/5-mediated gene transfer is reduced in the aged rat midbrain. Neurobiol Aging 36:1110-20.
19.
Moore T. (2005). Restoring retinal function in a mouse model of hereditary blindness. PLoS Med 2:e399.
20.
Russell S, J Bennett, JA Wellman, DC Chung, ZF Yu, A Tillman, J Wittes, J Pappas, O Elci, S McCague, D Cross, KA Marshall, J Walshire, TL Kehoe, H Reichert, M Davis, L Raffini, LA George, FP Hudson, L Dingfield, X Zhu, JA Haller, EH Sohn, VB Mahajan, W Pfeifer, M Weckmann, C Johnson, D Gewaily, A Drack, E Stone, K Wachtel, F Simonelli, BP Leroy, JF Wright, KA High and AM Maguire. (2017). Efficacy and safety of voretigene neparvovec (AAV2-hRPE65v2) in patients with RPE65-mediated inherited retinal dystrophy: a randomised, controlled, open-label, phase 3 trial. Lancet 390:849-860.
21.
Dulsat C. (2017). American Academy of Neurology - 69th Annual Meeting (April 22-28, 2017 - Boston, Massachusetts, USA). Drugs Today (Barc) 53:309-319.
22.
Annexstad EJ, I Lund-Petersen and M Rasmussen. (2014). Duchenne muscular dystrophy. Tidsskr Nor Laegeforen 134:1361-4.
23.
Blankinship MJ, P Gregorevic and JS Chamberlain. (2006). Gene therapy strategies for Duchenne muscular dystrophy utilizing recombinant adeno-associated virus vectors. Mol Ther 13:241-9.
24.
Kawecka K, M Theodoulides, Y Hasoglu, S Jarmin, H Kymalainen, A Le-Heron, L Popplewell, A Malerba, G Dickson and T Athanasopoulos. (2015). Adeno-Associated Virus (AAV) Mediated Dystrophin Gene Transfer Studies and Exon Skipping Strategies for Duchenne Muscular Dystrophy (DMD). Curr Gene Ther 15:395-415.
25.
Kodippili K, CH Hakim, X Pan, HT Yang, Y Yue, Y Zhang, JH Shin, NN Yang and D Duan. (2018). Dual AAV Gene Therapy for Duchenne Muscular Dystrophy with a 7-kb Mini-Dystrophin Gene in the Canine Model. Hum Gene Ther 29:299-311.
26.
Duan D. (2018). Systemic AAV Micro-dystrophin Gene Therapy for Duchenne Muscular Dystrophy. Mol Ther 26:2337-2356.
27.
Santagostino E and MR Fasulo. (2013). Hemophilia a and hemophilia B: different types of diseases? Semin Thromb Hemost 39:697-701.
28.
Nichols T, MH Whitford, VR Arruda, HH Stedman, MA Kay and KA High. (2014). Translational Data from AAV-Mediated Gene Therapy of Hemophilia B in Dogs. Hum Gene Ther Clin Dev.
29.
Crudele JM, JD Finn, JI Siner, NB Martin, GP Niemeyer, S Zhou, F Mingozzi, CD Lothrop, Jr. and VR Arruda. (2015). AAV liver expression of FIX-Padua prevents and eradicates FIX inhibitor without increasing thrombogenicity in hemophilia B dogs and mice. Blood 125:1553-61.
30.
Hasbrouck NC and KA High. (2008). AAV-mediated gene transfer for the treatment of hemophilia B: problems and prospects. Gene Ther 15:870-5.
31.
Brimble MA, UM Reiss, AC Nathwani and AM Davidoff. (2016). New and improved AAVenues: current status of hemophilia B gene therapy. Expert Opin Biol Ther 16:79-92.
32.
Grieger JC and RJ Samulski. (2005). Packaging capacity of adeno-associated virus serotypes: impact of larger genomes on infectivity and postentry steps. J Virol 79:9933-44.
33.
Selot RS, S Hareendran and GR Jayandharan. (2014). Developing immunologically inert adeno-associated virus (AAV) vectors for gene therapy: possibilities and limitations. Curr Pharm Biotechnol 14:1072-82.
34.
Bartlett JS, R Wilcher and RJ Samulski. (2000). Infectious entry pathway of adeno-associated virus and adeno-associated virus vectors. J Virol 74:2777-85.
35.
Ding W, L Zhang, Z Yan and JF Engelhardt. (2005). Intracellular trafficking of adeno-associated viral vectors. Gene Ther 12:873-80.
36.
Srivastava A. (2008). Adeno-associated virus-mediated gene transfer. J Cell Biochem 105:17-24.
37.
Berns KI. (1990). Parvovirus replication. Microbiol Rev 54:316-29.
38.
Pereira DJ, DM McCarty and N Muzyczka. (1997). The adeno-associated virus (AAV) Rep protein acts as both a repressor and an activator to regulate AAV transcription during a productive infection. J Virol 71:1079-88.
39.
Calcedo R and JM Wilson. (2013). Humoral Immune Response to AAV. Front Immunol 4:341.
40.
Mingozzi F and KA High. (2013). Immune responses to AAV vectors: overcoming barriers to successful gene therapy. Blood 122:23-36.
41.
Weitzman MD and RM Linden. (2011). Adeno-associated virus biology. Methods Mol Biol 807:1-23.
42.
Gao G, MR Alvira, S Somanathan, Y Lu, LH Vandenberghe, JJ Rux, R Calcedo, J Sanmiguel, Z Abbas and JM Wilson. (2003). Adeno-associated viruses undergo substantial evolution in primates during natural infections. Proc Natl Acad Sci U S A 100:6081-6.
43.
Hauck B, L Chen and W Xiao. (2003). Generation and characterization of chimeric recombinant AAV vectors. Mol Ther 7:419-25.
44.
Rabinowitz JE, DE Bowles, SM Faust, JG Ledford, SE Cunningham and RJ Samulski. (2004). Cross-dressing the virion: the transcapsidation of adeno-associated virus serotypes functionally defines subgroups. J Virol 78:4421-32.
45.
Manno CS, AJ Chew, S Hutchison, PJ Larson, RW Herzog, VR Arruda, SJ Tai, MV Ragni, A Thompson, M Ozelo, LB Couto, DG Leonard, FA Johnson, A McClelland, C Scallan, E Skarsgard, AW Flake, MA Kay, KA High and B Glader. (2003). AAV-mediated factor IX gene transfer to skeletal muscle in patients with severe hemophilia B. Blood 101:2963-72.
46.
Bartlett JS, RJ Samulski and TJ McCown. (1998). Selective and rapid uptake of adeno-associated virus type 2 in brain. Hum Gene Ther 9:1181-6.
47.
Richter M, A Iwata, J Nyhuis, Y Nitta, AD Miller, CL Halbert and MD Allen. (2000). Adeno-associated virus vector transduction of vascular smooth muscle cells in vivo. Physiol Genomics 2:117-27.
48.
Koeberl DD, IE Alexander, CL Halbert, DW Russell and AD Miller. (1997). Persistent expression of human clotting factor IX from mouse liver after intravenous injection of adeno-associated virus vectors. Proc Natl Acad Sci U S A 94:1426-31.
49.
Pajusola K, M Gruchala, H Joch, TF Luscher, S Yla-Herttuala and H Bueler. (2002). Cell-type-specific characteristics modulate the transduction efficiency of adeno-associated virus type 2 and restrain infection of endothelial cells. J Virol 76:11530-40.
50.
Qing K, C Mah, J Hansen, S Zhou, V Dwarki and A Srivastava. (1999). Human fibroblast growth factor receptor 1 is a co-receptor for infection by adeno-associated virus 2. Nat Med 5:71-7.
51.
Summerford C and RJ Samulski. (1998). Membrane-associated heparan sulfate proteoglycan is a receptor for adeno-associated virus type 2 virions. J Virol 72:1438-45.
52.
Summerford C, JS Bartlett and RJ Samulski. (1999). AlphaVbeta5 integrin: a co-receptor for adeno-associated virus type 2 infection. Nat Med 5:78-82.
53.
Shi W, A Hemminki and JS Bartlett. (2006). Capsid modifications overcome low heterogeneous expression of heparan sulfate proteoglycan that limits AAV2-mediated gene transfer and therapeutic efficacy in human ovarian carcinoma. Gynecol Oncol 103:1054-62.
54.
Wang Z, T Zhu, C Qiao, L Zhou, B Wang, J Zhang, C Chen, J Li and X Xiao. (2005). Adeno-associated virus serotype 8 efficiently delivers genes to muscle and heart. Nat Biotechnol 23:321-8.
55.
Nakai H, S Fuess, TA Storm, S Muramatsu, Y Nara and MA Kay. (2005). Unrestricted hepatocyte transduction with adeno-associated virus serotype 8 vectors in mice. J Virol 79:214-24.
56.
Gao G, LH Vandenberghe, MR Alvira, Y Lu, R Calcedo, X Zhou and JM Wilson. (2004). Clades of Adeno-associated viruses are widely disseminated in human tissues. J Virol 78:6381-8.
57.
Saraiva J, RJ Nobre and L Pereira de Almeida. (2016). Gene therapy for the CNS using AAVs: The impact of systemic delivery by AAV9. J Control Release 241:94-109.
58.
Alisky JM, SM Hughes, SL Sauter, D Jolly, TW Dubensky, Jr., PD Staber, JA Chiorini and BL Davidson. (2000). Transduction of murine cerebellar neurons with recombinant FIV and AAV5 vectors. Neuroreport 11:2669-73.
59.
Burger C, OS Gorbatyuk, MJ Velardo, CS Peden, P Williams, S Zolotukhin, PJ Reier, RJ Mandel and N Muzyczka. (2004). Recombinant AAV viral vectors pseudotyped with viral capsids from serotypes 1, 2, and 5 display differential efficiency and cell tropism after delivery to different regions of the central nervous system. Mol Ther 10:302-17.
60.
Davidson BL, CS Stein, JA Heth, I Martins, RM Kotin, TA Derksen, J Zabner, A Ghodsi and JA Chiorini. (2000). Recombinant adeno-associated virus type 2, 4, and 5 vectors: transduction of variant cell types and regions in the mammalian central nervous system. Proc Natl Acad Sci U S A 97:3428-32.
61.
Gao GP, MR Alvira, L Wang, R Calcedo, J Johnston and JM Wilson. (2002). Novel adeno-associated viruses from rhesus monkeys as vectors for human gene therapy. Proc Natl Acad Sci U S A 99:11854-9.
62.
Chao H, Y Liu, J Rabinowitz, C Li, RJ Samulski and CE Walsh. (2000). Several log increase in therapeutic transgene delivery by distinct adeno-associated viral serotype vectors. Mol Ther 2:619-23.
63.
Blankinship MJ, P Gregorevic, JM Allen, SQ Harper, H Harper, CL Halbert, AD Miller and JS Chamberlain. (2004). Efficient transduction of skeletal muscle using vectors based on adeno-associated virus serotype 6. Mol Ther 10:671-8.
64.
Halbert CL, JM Allen and AD Miller. (2001). Adeno-associated virus type 6 (AAV6) vectors mediate efficient transduction of airway epithelial cells in mouse lungs compared to that of AAV2 vectors. J Virol 75:6615-24.
65.
Kotterman MA and DV Schaffer. (2014). Engineering adeno-associated viruses for clinical gene therapy. Nat Rev Genet 15:445-51.
66.
Zhong L, B Li, CS Mah, L Govindasamy, M Agbandje-McKenna, M Cooper, RW Herzog, I Zolotukhin, KH Warrington, Jr., KA Weigel-Van Aken, JA Hobbs, S Zolotukhin, N Muzyczka and A Srivastava. (2008). Next generation of adeno-associated virus 2 vectors: point mutations in tyrosines lead to high-efficiency transduction at lower doses. Proc Natl Acad Sci U S A 105:7827-32.
67.
Lochrie MA, GP Tatsuno, B Christie, JW McDonnell, S Zhou, R Surosky, GF Pierce and P Colosi. (2006). Mutations on the external surfaces of adeno-associated virus type 2 capsids that affect transduction and neutralization. J Virol 80:821-34.
68.
Munch RC, H Janicki, I Volker, A Rasbach, M Hallek, H Buning and CJ Buchholz. (2013). Displaying high-affinity ligands on adeno-associated viral vectors enables tumor cell-specific and safe gene transfer. Mol Ther 21:109-18.
69.
Grimm D and S Zolotukhin. (2015). E Pluribus Unum: 50 Years of Research, Millions of Viruses, and One Goal--Tailored Acceleration of AAV Evolution. Mol Ther 23:1819-31.
70.
Maheshri N, JT Koerber, BK Kaspar and DV Schaffer. (2006). Directed evolution of adeno-associated virus yields enhanced gene delivery vectors. Nat Biotechnol 24:198-204.
71.
Khabou H, M Desrosiers, C Winckler, S Fouquet, G Auregan, AP Bemelmans, JA Sahel and D Dalkara. (2016). Insight into the mechanisms of enhanced retinal transduction by the engineered AAV2 capsid variant -7m8. Biotechnol Bioeng 113:2712-2724.
72.
Kienle E, E Senis, K Borner, D Niopek, E Wiedtke, S Grosse and D Grimm. (2012). Engineering and evolution of synthetic adeno-associated virus (AAV) gene therapy vectors via DNA family shuffling. J Vis Exp.
Other knowledge bases
| AAV Knowledge Base | Adenovirus Knowledge Base | Lentivirus Knowledge Base |







 Facebook
Facebook LinkedIn
LinkedIn Twitter
Twitter
