항체-약물 접합체 (Antibody-Drug Conjugate, ADC)의 주요 요소: 링커 (분해성/비분해성, 구조 및 기전)
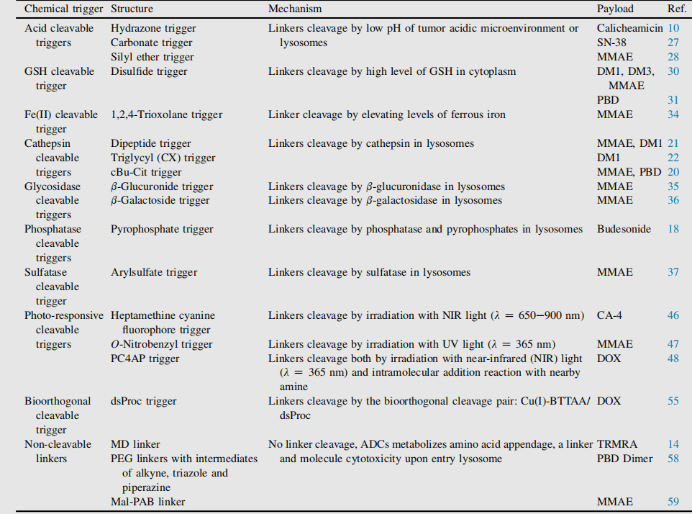
접합 링커는 항체와 소분자 페이로드(payload)를 공유 결합으로 연결하는 분자 부분일 뿐만 아니라, 표적 약물 치료에서 설계상의 핵심 요소입니다. 링커의 부가는 응집(aggregation)을 유발해서는 안 되며, 허용 가능한 약동학(pharmacokinetics, PK) 특성을 확보하고 혈장 내 페이로드의 조기 방출(안정성)을 제한하며, 표적 부위에서 활성 분자를 효과적으로 방출할 수 있어야 합니다. 이 결합 과정에서 여러 제약사가 접합 링커 개발에 참여하고 있으며, 링커는 크게 분해 불가능한(non-cleavable) 링커와 분해 가능한(cleavable) 링커로 구분됩니다1.
분해 불가능한 링커를 사용하는 ADC는 반드시 세포 내로 내부화되어야 하며, 항체 부분은 리소좀(proteolysis in lysosomes) 내 단백질 분해효소에 의해 분해되어 활성 분자가 방출됩니다. 지금까지 많은 미분해 링커가 ADC 개발에서 연구되었으며, 그 중 가장 대표적인 것은 n-석신이미드-4-(n-말레이이미드 메틸) 시클로헥산-1-카복실레이트(SMCC, SMCC)로, Kadcyla®에서 사용되고 있습니다2.
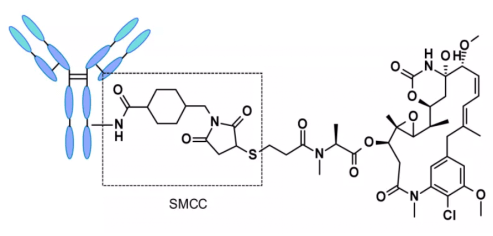
이 구조의 대사(catabolism)는 lys-smc-dm1이 주요 종양 대사산물로 생성되게 합니다. 또한, 이 링커에 결합된 약물은 방출된 대사산물이 투과성이 낮아 바이스탠더(bystander) 효과가 나타나지 않습니다. 현재 연구는 주로 분해 가능한 링커에 집중되고 있습니다[6-7].
분해 가능한 링커의 사용은 내부화 ADC와 비내부화 ADC의 설계 모두에 적용 가능하며, 이는 방출이 절단 부위(리소좀 및/또는 종양 미세환경)의 특성에 의해 유도되기 때문입니다. 링커는 두 가지 범주로 나눌 수 있습니다. 하나는 효소 의존성(enzyme dependent)이고, 다른 하나는 화학적(비효소, non enzyme dependent)입니다(두 경우 모두 접합체 제조에 사용됨).
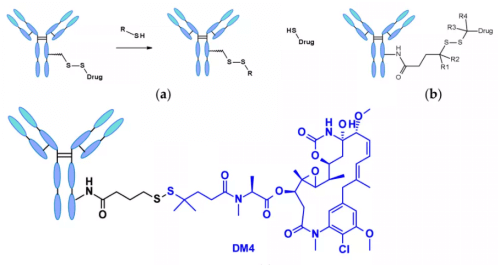
화학적 의존성 링커: 디설파이드 결합을 포함하는 링커는 메르캅탄(mercaptan)에 의해 공격받아 활성 페이로드를 방출합니다. 혈장 내에서 환원된 형태의 인간 혈청 알부민(human serum albumin, HSA)은 가장 풍부한 메르캅탄이지만, 거대분자와 반응성이 매우 낮습니다3. 또한, 세포질에는 티올기를 포함하는 트리펩타이드인 글루타티온(glutathione, GSH)이 높은 농도로 존재하여 S-친화성 단백질과 쉽게 반응합니다. 혈액(마이크로몰 범위)와 세포질(밀리몰 범위) 내 GSH 농도의 차이와 암세포에서 발생하는 산화 스트레스가 암세포 내 약물 방출을 우선시하는 요인이 됩니다. 디설파이드 결합 링커는 주로 메이탄시노이드(maytansinoid) 페이로드와 관련이 있으며, 디설파이드 결합의 반응성은 입체 장애(steric hindrance)에 의해 조절될 수 있습니다. 예를 들어, α-메틸 치환은 환원 속도와 메르캅탄에 의한 디설파이드 교환에 크게 영향을 미칩니다. 예로, sar-3419의 링커는 디메틸 치환을 통해 spdb-DM4의 최상의 항종양 활성을 얻습니다.
하이드라존 링커는 pH 의존적인 안정성을 보이며, 중성 pH에서는 안정하고 산성 환경(엔도솜 pH < 6, 리소좀 pH < 5)에서 가수분해되어 해당 케톤과 하이드라진을 형성합니다.
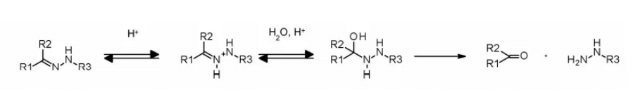
이 방법은 하이드라존 링커를 포함한 immu-110에 성공적으로 적용되었으며, 이는 4-말레이이미드 메틸시클로헥산-1-카복실레이트(MCC, MCC)의 하이드라지드와 아드리아마이신에 존재하는 케톤 그룹이 반응하여 형성됩니다.
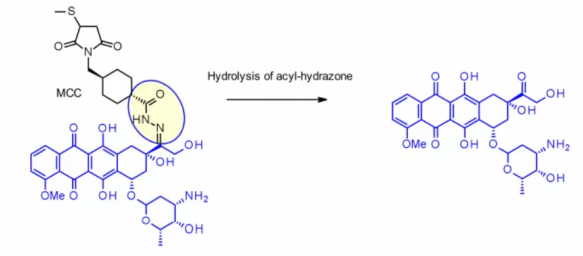
하이드라존 링커는 칼리미신(calimycin) 계열의 페이로드에도 자주 사용됩니다. 이 경우, 방출은 두 단계의 활성화 과정에 의해 유도되는데, 첫 단계는 산에 민감한 하이드라존이 가수분해되고, 두 번째 단계는 디설파이드 결합이 GSH에 의해 환원되어 티올 중간체가 고리화되는 것입니다. 이 링커는 Mylotarg®와 Besponsa®에 사용되었으나, 혈장 내 안정성이 기대에 미치지 못해 다른 분해 가능한 링커만큼 매력적이지 않습니다.
효소 의존성 링커: 페이로드의 내부화 이전 방출을 제한하여 표적 세포의 분해를 방지하거나 최소화하기 위해, 리소좀 내 단백질 성분에서 ADC를 분해할 수 있는 효소를 찾는 것이 타당합니다.
카테프신 B
카테프신 B는 시스테인 프로테아제(cysteine protease)로, 포유류의 후기 엔도솜과 리소좀에 존재하며, 많은 암세포에서 과발현됩니다. 처음에는 카테프신 B의 기질로서 분해 가능한 다이펩타이드가 사용되어 아드리아마이신 프로드러그가 개발되었으며, 이 연구를 통해 SAR의 다이펩타이드 부분에서는 P1 자리에 친수성 잔기(시트룰린 또는 아르기닌), P2 자리에 소수성 잔기(페닐알라닌, 발린 또는 알라닌)를 배치하면 혈장 안정성이 향상됨이 입증되었습니다.
또한, 효소의 접근성을 높이기 위해 자기분해 스페이서(self degradation spacer)가 도입되어 페이로드의 입체 장애를 완화하며, 산성 환경에서 p-아미노벤질카르바메이트(PABA, PABA)의 자발적 1,6-제거가 일어나 이산화탄소, p-아자키논 포름아미드 및 아드리아마이신이 방출됩니다.
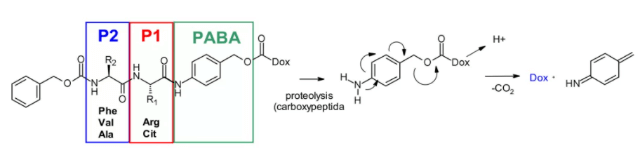
Val-Cit 다이펩타이드는 ADC에서 가장 널리 사용되는 분해 가능한 링커입니다. 현재 임상 단계의 분자는 최대 25종에 달하며, 이는 전반적으로 혈장 안정성, 방출 거동 및 화학적 조작성이 우수하기 때문입니다. 승인된 ADC 의약품(Adcetris®, Polyvy® 등)은 말레이이미드 스페이서, 표준 Val-Cit 다이펩타이드 서열(카테프신 기질) 및 PABC(self degradation spacer)를 포함하는 동일한 링커 MC VC PABC를 사용합니다.
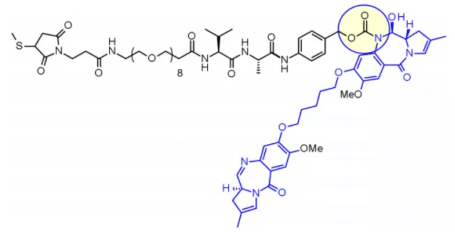
Val-Ala 다이펩타이드 또한 널리 사용되며, 임상 단계에서는 7종의 분자가 보고되고 있습니다. 가장 빠른 진전 예로는 PEG화된 스페이서를 포함하여 PBD 다이머 계열의 페이로드 sg3199의 지용성을 조절한 loncastuximab tesirine가 있습니다.
연구 결과, Val-Cit 링커는 침전 및 응집으로 인해 높은 DAR(Drug-to-Antibody Ratio, DAR) 달성이 어렵지만, Val-Ala 링커는 응집이 제한적(< 10%)으로 DAR가 최대 7.4까지 도달할 수 있음을 보여줍니다. Val-Cit과 비교하여 Val-Ala는 소수성이 낮아, PBD 다이머와 같은 지용성 페이로드에 탁월한 성능을 발휘합니다. 7개의 임상 후보 ADC에서는 Val-Ala 링커가 PBD에 결합되어 있습니다.
일부 연구에서는 MMAE 페이로드와 결합된 경우, 내부화되지 않은 항체에 대해 엔지니어링된 시스테인에 결합한 Val-Cit와 Val-Ala 다이펩타이드 링커가 유사한 특성을 보이며, Val-Lys 및 Val-Arg 유사체보다 우수한 성능을 나타내는 것으로 비교되었습니다. 반면, 무작위 시스테인 결합 항체에 대해서는, 항HER2 ADC에서 Val-Ala 링커가 높은 DAR 구조에서 Val-Cit에 비해 응집이 덜 나타났습니다. 두 링커는 완충액 안정성, 카테프신 B에 의한 방출 효율, 세포 활성 및 조직병리학적 특성 면에서는 유사한 결과를 보입니다.
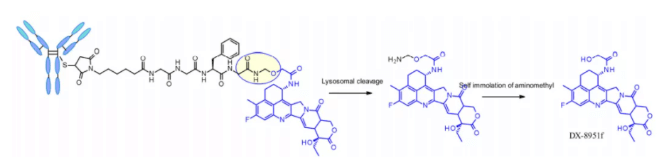
테트라펩타이드 Gly-Gly-Phe-Gly는 안정적이고 효과적인 분해 가능한 링커의 모든 특성을 나타내며, 이는 ADC 의약품 Enhertu®에 적용되었습니다. Enhertu의 첫 번째 단계는 혈장 안정성이 뛰어나고 DAR이 7.7인 ADC이며, 리소좀 내에서 단백질 분해가 일어나 dx-8951f가 방출됩니다. 이는 Exatecan에서 유래한 효과적인 토포이소머라제 I 억제제입니다. 이 링커는 가용화 보조제가 포함되어 있지 않음에도 불구하고 높은 DAR을 달성하는데, 이는 높은 DAR 접합체는 약동학 특성이 열악할 것이라는 기존의 원칙에 반하는 결과로 매우 주목할 만합니다. 여기서 사용된 자기분해 스페이서는 Val-Cit 링커에서 사용되는 PABC가 아닌 단순하고 소형의 헤미아민화물입니다.
인산분해효소(Phosphatase) 및 피로인산분해효소(Pyrophosphatase)
카테프신과 유사하게, 피로인산분해효소 및 인산분해효소는 라이소좀에서 선택적으로 발현되는 가수분해효소입니다. 2016년에 Merck 연구진은 카테프신 B에 민감한 Val-Cit PABA와 결합할 수 있도록 인산 및 피로인산을 포함하는 링커를 설계하여 글루코코르티코이드를 전달하는 시스템을 제시하였습니다. 이때, 인산/피로인산 그룹은 자기분해 스페이서 PABA와 페이로드 사이에 부분적으로 결합하며, 내부화 후에는 카테프신 B, 자기분해 스페이서, 그리고 인산분해효소의 순서로 페이로드가 방출됩니다(여기서 n=1). 피로인산의 경우(n=2) 추가적인 피로인산분해효소 단계가 필요할 수 있습니다.
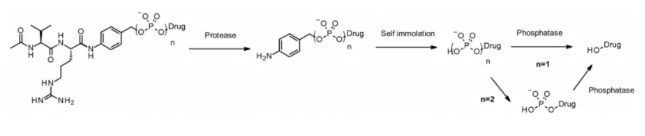
이 친수성이며 영구적으로 전하를 띠는 그룹은 용해성(solvability)의 장점을 제공하며, 지용성 글루코코르티코이드 유도체와 생체결합할 뿐만 아니라 ADC의 정제도 촉진합니다. ADC 내 잔류 링커는 0.10% 미만이며, 인산 및 피로인산을 포함한 ADC는 in vitro에서 활성을 나타냅니다.
β-글루쿠로니다제(β-Glucuronidase)
β-글루쿠로니다제는 글루쿠론산 잔기의 β-가수분해를 촉매하는 글리코시다아제(glycosidase)로, 라이소좀 및 종양 기질에서 고발현됩니다. 2006년 Seattle Genetics 연구진은 항-CD70 ADC에 글루쿠론산을 포함한 링커를 적용한 혁신적인 연구 결과를 발표하였으며, 이 링커는 자기분해 스페이서를 통해 결합되어 응집이 낮고, 혈장 안정성이 높으며, in vivo에서 강력한 효능을 보입니다5.
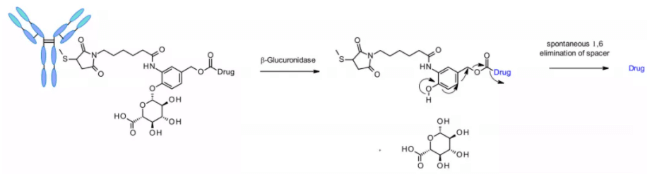
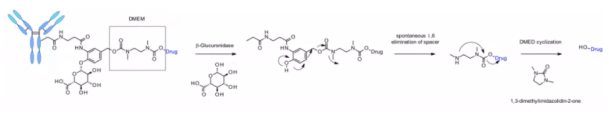
이 링커는 또한 카ンプ토테킨 유사체, SN38, 듀카마이신, 마트린 등 아민기를 포함하는 페이로드에, 추가적인 디메틸에틸렌디아민(DMED, DMED) 자기분해 스페이서를 통해 적용됩니다. 가수분해에 의해, β-글루쿠론산에서 자기분해 스페이서로의 방출 후, DMED의 자발적 고리형 반응이 일어나 1,3-디메틸이미다졸린-2-온이 형성되고, 최종적으로 하이드록실기를 가진 약물이 방출됩니다. 링커의 친수성 덕분에, 카테프신 민감 링커에 비해 이 기술은 DAR=8 ADC의 제조를 더 용이하게 만듭니다.
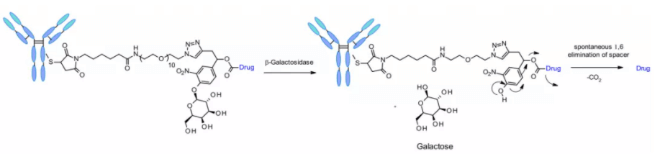
β-갈락토시다제(β-Galactosidase)
β-갈락토시다제는 글루쿠론산 잔기의 β-가수분해를 촉매하는 글리코시다제로, 라이소좀과 종양 기질에서 발현됩니다. 최근 Seattle Genetics의 연구진은 항-HER2 ADC에 글루쿠론산을 포함한 링커를 적용한 혁신적인 연구를 발표하였으며, 이 링커는 낮은 응집도, 높은 혈장 안정성, 강력한 in vivo 효능을 나타냅니다.
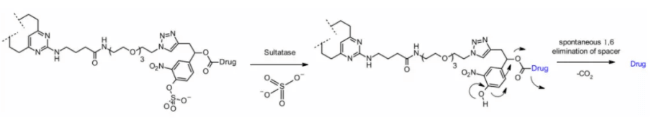
설포타제(Sulfatase)
최근 몇몇 암종에서 과발현되어 선택성을 보일 가능성이 있는 설포타제에 의해 절단되는 링커도 보고되고 있습니다. 한 연구에서는 항-HER2 항체에 MMAE가 결합된 ADC를 대상으로 고전적인 분해 가능한 Val-Cit 및 Val-Ala 링커와 비교하여, 설포타제 링커가 유사한 효능을 보임을 확인하였습니다.
Reference:







 항체-약물 접합체(ADC) 지식 베이스 보기:
항체-약물 접합체(ADC) 지식 베이스 보기: Facebook
Facebook LinkedIn
LinkedIn Twitter
Twitter
